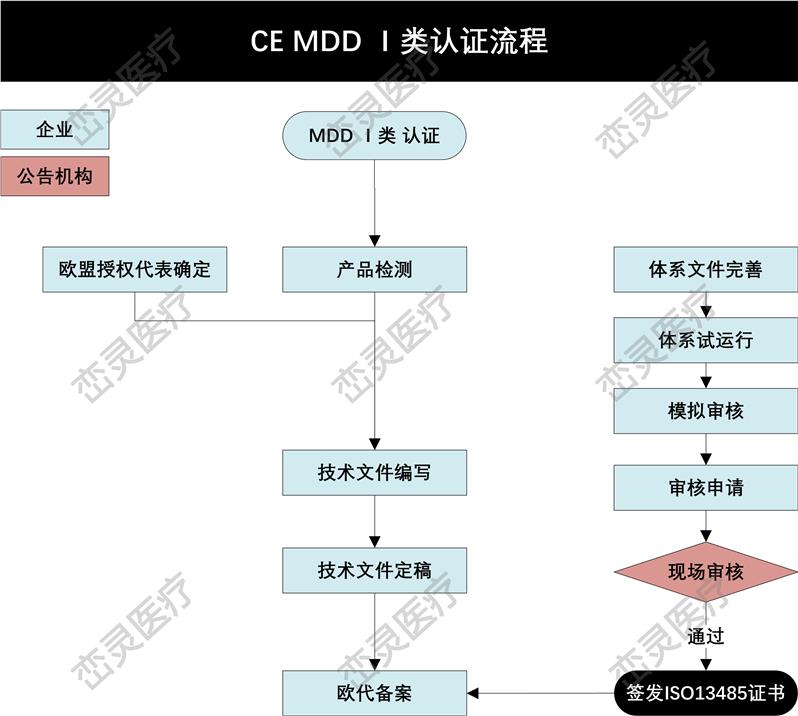
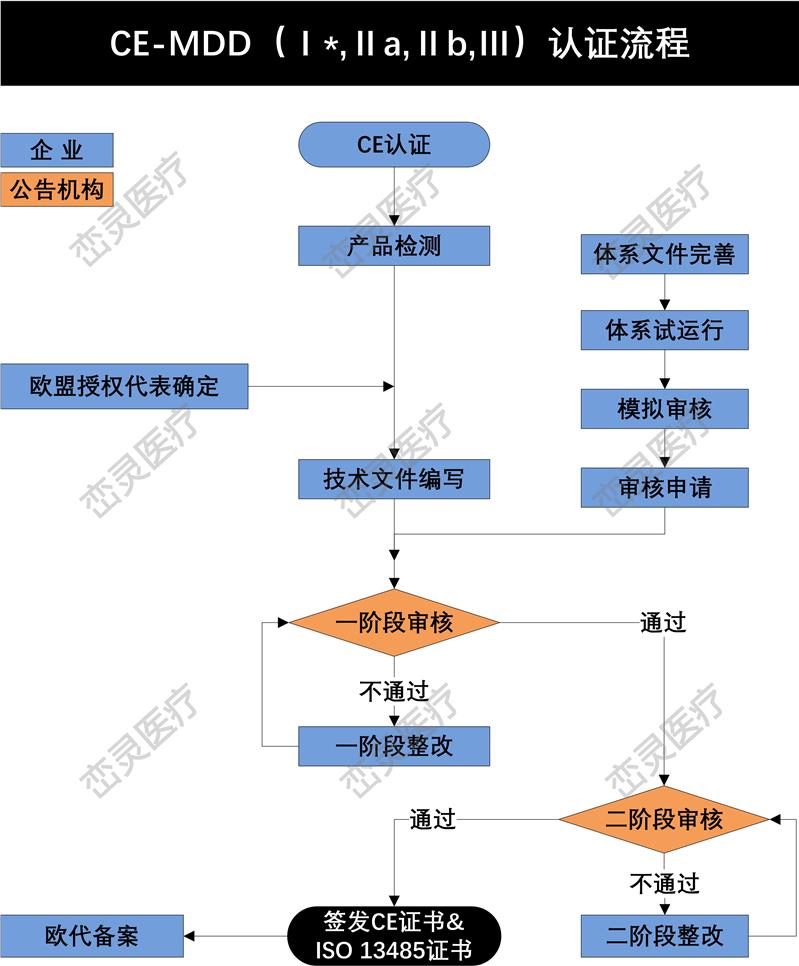
- 产品描述
上海峦灵信息技术有限公司的服务包括:
法规合规服务(CE认证、NMPA注册、FDA注册、**注册)
**注册(加拿大、澳大利亚、日本、巴西、韩国、俄罗斯、东南亚注等);
法规培训服务(企业定制培训、小班课培训)
测试服务(有源产品测试咨询、无源产品测试咨询、清洗消毒灭菌验证确认、定制化摸底测试服务)
质量管理体系(ISO13485、NMPA GMP、MDSAP、FDA QSR820、质量体系日常维护服务);
产品上市前的注册
1. 经济运营商注册
① 制造商或欧代以及进口商递交信息进行注册(Annex VI, Part A, Sec. 1)=>确保及时较新;
② 主管部门提供Single Registration Number(SRN):用于提供给公告机构,或者访问EUDAMED。
2. 制造商分配基本UDI-DI给器械。
3. 获取CE:公告机构进行符合性评定,颁发CE,确认EUDAMED中信息的正确性。(注:在特定类型的CE上还将引用Basic UDI-DI。)
4. 制造商提供基本UDI-DI、UDI-DI、SRN和**数据元素给UDI数据库(Annex VI, Part B) =>确保及时较新
5. 产品注册:制造商在EUDAMED中输入或验证产品注册信息(包括基本UDI-DI)(Annex VI, Part A, Sec. 2)=>确保及时较新
6. 产品上市
GSPR 10.4.2 含有CMR/干扰物的理由 – New!
说明包含此类物质的理由应从以下方面考虑:
a) 潜在患者和使用者暴露情况分析
b) 替代品的分析
c) 可能的替代品或设计变更不适用的分析
d) 科学会的文件
根据欧洲法规的要求,制造商应起草符合性声明,对于加贴CE标志上市的产品的符合性负有责任。因此,制造商在产品进入欧洲市场前,需要估并选定适用的指令和符合性路径,确保产品符合法规要求,然后加贴CE标志。其主要过程包括:
? 对于Class III或可植入器械:
- 制造商应通过电子系统递交PSUR给公告机构。
- 公告机构应评审PSUR,并将评价及任何措施的细节记录在电子系统中。
- 主管部门可以通过电子系统获取PSUR及公告机构的评价。
峦灵欧盟市场准入整体解决方案
服务内容包括CE技术文档撰写、辅导、测试、认证方案。
还包括欧代服务、欧盟FSC、WEEE、Rohs、ISO14971 风险分析、价、灭菌、软件周期、可用性等欧盟合规的咨询与服务。
峦灵是行业内的咨询公司,汇聚了来自法规、等各领域对法规有深刻理解的人士及*,致力为企业提供一站式、*、系统化的技术咨询服务, 帮助企业向**市场提供安全、有效和合规的产品, 迄今为止,我们已与众多公司开展合作, 协助他们将安全、有效、合规的产品迅速推向**市场。 我们的服务包括: 法规合规服务(CE认证、NMPA注册、FDA注册、**注册) 质量管理体系(ISO13485、NMPA GMP、MDSAP、FDA QSR820、质量体系日常维护服务); 测试服务(有源产品测试认证咨询、无源产品测试认证咨询、清洗消毒灭菌验证确认、定制化摸底测试服务) **注册(加拿大、澳大利亚、日本、巴西、韩国、俄罗斯、东南亚注等); 法规培训服务(企业定制培训、小班课培训)
欢迎来到上海峦灵医疗信息技术有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海青浦公司街道地址,负责人是阮贞。
主要经营CE认证 FDA510K。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:CE认证,FDA注册,**注册等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们最大的收益、用户的信赖是我们最大的成果。
本页链接:http://www.cg160.cn/vgy-53474476.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
关于上海峦灵医疗信息技术有限公司
商铺首页 |
更多产品 |
联系方式
峦灵是行业内的咨询公司,汇聚了来自法规、等各领域对法规有深刻理解的人士及*,致力为企业提供一站式、*、系统化的技术咨询服务, 帮助企业向**市场提供安全、有效和合规的产品, 迄今为止,我们已与众多公司开展合作, 协助他们将安全、有效、合规的产品迅速推向**市场。 我们的服务包括: 法规合规服务(CE认证、NMPA注..
- 我要给“铁岭医疗器械CE认证”留言
- 更多产品
相关分类