- 产品描述
医疗器械MDD认证
医疗器械MDD认证
医疗器械CE认证简介
在医疗器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。分别为:
医疗器械指令MDD(Medical Devices):93/42/EEC,适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械。
体外诊断指令IVDD(In vitro diagnostic medical devices):98/79/EC,适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。
有源植入性医疗器械指令AIMDD(Active implantable medical devices):90/385/EEC,适用于心脏起搏器,可植入的泵等有源植入性医疗器械。
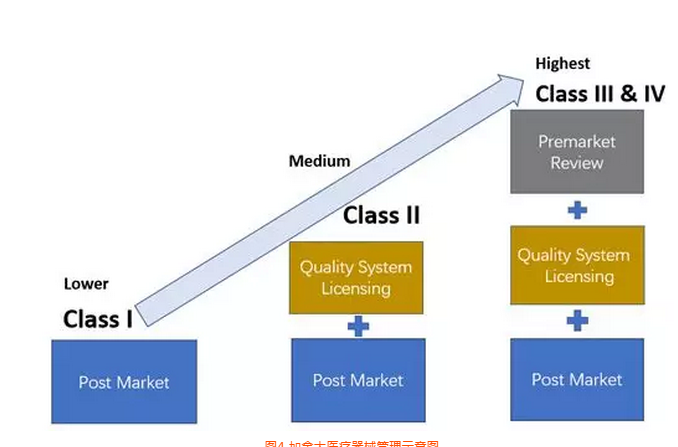
医疗器械MDD指令的分类等级
MDD指令根据不同的要求共分为6个等级,供认证机构评估:
等级 设计阶段 生产阶段
I类 自我符合声明 自我符合声明
I类(测量功能) 自我符合声明 申报机构
I类(灭菌) 自我符合声明 申报机构
II a类 自我符合声明 申报机构
II b类 申报机构 申报机构
III类 申报机构 申报机构
医疗器械CE认证所需技术资料
认证机构的统一评估包括根据指令规定的基本要求评审技术文件、根据标准EN 46001 或 EN/ISO 13485评审质量体系。医疗设备CE认证技术档案所需内容:
- 生产商/或欧洲代表名址;
- 产品及型号描述;
- EC符合声明书;
- 风险评估;
- 基本安全点检表;
- 适用之调合标准/或其他标准;
- 市场反馈及抱怨分析;
- 使用说明及标签;
- 授权代表;
- 线路、图表(适用的话);
- 计算书、测试报告或其它证明材料;
- 检验过程及过程描述;
- 灭菌或其它特殊过程(适用的话);
- 灭菌类产品的包装材料及方法;
-质量体系、质量手册;
一、MDR的主要变化
1.扩大了应用范围
2.提出了新的概念和器械的定义
3.细化了医疗器械的分类
4.完善了器械的通用安全和性能要求
5.加强对技术文件的要求
6.加强器械上市后的监管
7.完善临床评价相关要求
8.提出Eudamed数据库的建立和使用
9.提出器械的可追溯性(UDI)
10.对NB提出严格的要求
二、对NB提出的严格要求
对“公告机构”,新版MDR花费大篇幅对其进行职能和要求进行描述;各NB需按照附录VII的要求重新申请MDR的三方审核的授权
三、MDR适用范围扩大
新MDR不仅包含了MDD及AIMDD涵盖的所有产品;还覆盖专门用于器械的清洁、消毒或灭菌的器械,以及Annex XVI列举的无预期医疗目的的产品,如美瞳、面部填充或注射、纹身、皮肤改善和美容等产品。
包含某些药械结合产品,详细请见Article1(8,9)。
包含某些由非活性或处理为非活性的人类来源组织或细胞物制造的特定产品。
包含声称仅具有美容目的或另一种非医疗目的,但在功能和风险特征方面类似于医疗器械的特定产品组
声明纳米材料器械属于MDR范围,且要接受为严格的评估程序。
包含**离子辐射的器械和医疗用途的软件。
四、MDR提出了新的概念和器械的定义
MDR中增加了很多新的概念,从MDD中的14个概念,增加到现在的71个,如增加了一些临床试验方面和上市后监管方面的概念,如 “recall ,withdraw ,serious incident, clinical consent, clinical benefit(召回、撤回、严重事件、临床同意、临床受益)”.详情请见Article2
五、器械的分类变化
从MDD到MDR,器械仍分为四大类:I类、I*类(Is(一类灭菌)/Im(一类测量)/Ir(一类可重复使用))、IIa类、IIb类、III类,其中一类中可重复使用器械归属为I*类。
MDD中与分类相关是93/42/EEC中的 Annex IX 和相应的指南MEDDEV 2. 4/1 Rev. 9;新的MDR中Article51和Annex VIII 详细阐述了产品的分类信息。主要变化是由MDD的“18条”,改为MDR的“22条”。
器械类型 MDD MDR
NON-INVASIVE DEVICES Rule 1- Rule 4 Rule 1-Rule 4
INVASIVE DEVICES Rule 5-Rule 8 Rule 5-Rule 8
ACTIVE DEVICES Rule 9-Rule 12 Rule 9-Rule 13
SPECIAL RULES Rule 13-Rule 18 Rule 14-Rule 22
Rule1-Rule 4: NON-INVASIVE DEVICES非侵入性器械
Rule3: 增加了用于体外直接从人体或人类胚胎取外使用的人体细胞、组织、气管,然后再植入或注入体内,此类器械为III类。
Rule 5-Rule 8:INVASIVE DEVICES侵入性器械
Rule 8:在原来的基础上添加了:有源植入器械或其相关附件,植入物或心脏修补网状织物,完整或部分关节置换物,直接与脊柱接触的椎间盘置换植入物为III类。
Rule 9-Rule 13:ACTIVE DEVICES有源器械
Rule9:在原来的基础上增加了“针对**目的释放电离辐射的有源器械”以及“用于控制、监测或直接影响有源植入式器械”,这两大类器械均为II b类。
Rule11:新添加,提出用于提供诊断或**目的决策信息和监测生理过程的软件,均为II a类;其他软件类为I类。
Rule 14-Rule 22:SPECIAL RULES特殊规则
Rule14:进一步完善了“自人体血液或血浆的医疗产品”分类的要求。
Rule 18:进一步完善“利用非活性或处理为非活性的人体或动物源组织或细胞或其他物制成的器械”的分类要求。
Rule19:添加对纳米材料器械的分类要求。
Rule20:添加了通过吸入方式,与身体孔口相关的侵入器械的分类。
Rule 21:添加了引入人体可吸收物质到人体的器械。
Rule22: 添加了具有集成或合并诊断功能的有源**器械的分类。
此外还删除了MDD中对血袋的单独分类。
六、器械的通用安全和性能要求
由MDD中Annex 1 ESSENTIAL REQUIREMENTS 进一步完善为“ANNEX I GENERAL SAFETY AND PERFORMANCE REQUIREMENTS”;从原来的13个条款增加到现在的23个,同时MDD中 Article 13: Information supplied by the manufacturer 在MDR中作为一个单独的章节 “CHAPTER III REQUIREMENTS REGARDING THE INFORMATION SUPPLIED WITH THE DEVICE”。细化了多条性能要求,强调将风险分析和管理贯穿于设计和生产、销售、上市后监管等整个产品周期中。
七、技术文件的要求
MDR中添加了对技术文件内容的要求;且明确指出上市后监管计划和安全性较新报告(PSUR)都是技术文件的一部分,并要求依据上市后监管体系收集的资料对技术文件中相应信息进行较新。
八、技术文件的基本内容
器械说明与性能指标
包括变型和附件包含器械说明与性能指标,以及引用的前代和类似器械的信息。
制造商提供的信息
设计与制造信息
通用安全与性能要求
包含其符合附录I提供的通用安全与性能要求的证明资料。
风险利益分析和风险管理
产品验证与确认
临床前和临床数据(包含临床评价计划/报告,PMCF计划/报告);以及针对含药器械、人体/动物来源组织或其物制备的器械、引入人体并被吸收器械、具有测量功能器械等的相关附加信息
九、上市后监管的技术文件
AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE 详细说明了要按照Article83-86 编写上市后监管的文件,包含上市后监管计划、上市后监管报告或定期安全性较新报告(PSUR)。
十、符合性声明文件
ANNEX IV EU DECLARATION OF CONFORMITY 详细说明了“符合性声明”文件包含的内容。
十一、加强器械上市后监管体系
Chapter VII POST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 着重说明上市后监管、警戒和市场监管。
建立、实施和维护上市后监管体系(见Article83)。
强调上市后监管体系贯穿整个生命周期,并不断较新。
建立“上市后监管计划”(见Article84),具体内容见Annex III。
I类器械编写“上市后监管报告”(见Article85)。
IIa、IIb和III类器械编制“定期安全性较新报告(PSUR)”(见Article86)。
PSUR需定期较新并作为技术文件的一部分。
建立警戒和上市后监管电子系统(见Article 92)。
在整个器械使用寿命期间,依据实施PMCF后**的临床数据对临床评价及技术文件进行较新(Annex XIV part B)。
十二、完善临床评价相关要求
新法规提出:
要求根据Article61和附录XIV partA执行、评估、报告和较新临床评价资料;
提出对特定III类和IIb类器械,CER中要考虑咨询*小组的意见;
对植入和III类器械,提出考虑临床研究;
要求CER按照PMCF**数据进行较新;
针对III类和可植入器械,提出了CER较新的频率;
明确证明实质等同性需考虑的特点;
要求其与风险管理的相互作用
十三、Eudamed数据库
新法规提出:
明确欧洲医疗器械数据库(Eudamed)建立目的和包含的信息(Article 33);
信息的公开性:
要求III类器械和植入式器械,安全和临床性能信息通过Eudamed向公众开放。
十四、提出器械的可追溯性(UDI)
除定制和研究器械外,其他器械均需建立UDI系统;
UDI信息体现在标签或包装上(不包含集装箱);
UDI-DI信息需要载明于符合性声明中(见Article27);
Annex VI Part B提出UDI-DI包含的信息;
可植入、重复使用、软件、可配置器械的UDI有特殊要求(见Annex VI Part C)
包装或标签上UDI实施的时间见Article123 (f)。
UDI 发行实体由欧盟会*。
过渡性:Article 120指出“在会根据*27(2)条*发行实体前,GS1、HIBCC和ICCBBA应被视为*的发行实施
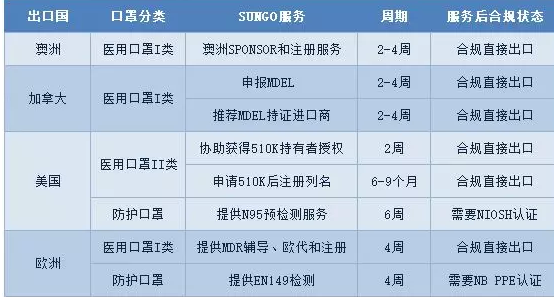
医疗器械CE认证
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,***等CE认证,全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
CE标志有何重要意义
CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合安全要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或退出市场。
CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有CE标志。显然,CE标志可作为器械在欧盟内的“通行证”。同时,一个医疗器械产品如果合法加贴了CE标志,也就表明:
1、 该医疗器械符合了欧盟医疗器械法规的基本要求;
2、 该医疗器械可以在欧盟市场内自由流通、销售及使用;
3、 该医疗器械的整个形成过程已通过了一个相应的符合性评价程序。
欧盟医疗器械CE指令
在医疗器械领域,欧盟会制定发布了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。 这三个指令分别是:
1.基础医疗器械指令(MDD,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
2.体外诊断器械指令(IVDD,98/79/EC),适用于血细胞计数器,血糖仪、妊娠检测试纸、诊断、优生诊断等体外诊断用医疗器械产品。
3.有源植入性医疗器械指令(AIMDD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性医疗器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上销售。
CE技术文件
CE技术文件是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。各欧盟指令对于"技术档案"的要求有所差别,在这里谨以中国出口企业常用的“医疗器械”的要求为例,加以说明。
医疗器械指令93/42/EEC要求"技术档案"可能包含:企业的质量手册和程序文件;企业简介及欧洲代表名称、联系方式;CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料),主要内容如下:
1、产品名称、分类
2、产品概述(包括类型和预期用途)
◇产品的历史沿革
◇技术性能参数
◇产品配合使用的附件、配合件和其它设备清单
◇产品的图示与样品
◇产品所用原材料及供应商
3、使用该产品的调和标准/或其它标准
(袁 (1381电8104话617)
4、风险分析评估结论和预防措施
5、生产质量控制
◇产品资料和控制文档(包括产品生产工艺流程图)
◇产品的灭菌方法和确认的描述
◇灭菌验证
◇产品质量控制措施
◇产品稳定性和效期的描述
6、包装和标识
◇包装材料说明
◇标签
◇使用说明书
7、技术评价
◇产品检验报告及相关文献
◇技术概要及*观点
8、风险管理
◇产品潜在风险报告及相关文献
◇潜在风险的概要及*观点
9、临床评价
◇产品临床测试报告及相关文献
◇临床使用概述及*观点
附1、产品出厂检测报告
附2、产品型式检测报告
附3、基本要求检查表
备注:
◇临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
◇生物兼容性测试(A)部分要求:细胞毒性、感光性、-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性; (B)支持测试:慢性中毒、致性、再生性/生长性、生物动因退化。)
◇临床资料(需要临床研究或描述临床研究)
◇包装合格证明
◇标签、使用说明
◇结论(设计档案资料的接受、利益对应风险的陈述)
10、欧盟授权代表信息及协议
11、符合基本要求表
12、协调标准
13、警戒系统程序
SUNGO集团是**化的医疗器械法规专业技术服务商。 SUNGO品牌包括六家公司,分别是位于美国的SUNGO Technical Service Inc.,位于英国的SUNGO Certification Company Limited,位于荷兰的SUNGO Europe B.V.,位于澳洲的SUNGO Australia,位于德国的SUNGO Cert GmbH和上海沙格企业管理咨询有限公司(含上海总部、武汉分公司和广州分公司)。
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于世界上面积最大的红松原始林所在地—伊春市。 具体地址是黑龙江伊春金山屯公司街道地址,负责人是袁阳。
主要经营FDA注册和FDA510K。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:商务服务 认证服务 等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们最大的收益、用户的信赖是我们最大的成果。
本页链接:http://www.cg160.cn/vgy-51664034.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
关于上海沙格企业管理咨询有限公司
商铺首页 |
更多产品 |
联系方式
SUNGO集团是**化的医疗器械法规专业技术服务商。 SUNGO品牌包括六家公司,分别是位于美国的SUNGO Technical Service Inc.,位于英国的SUNGO Certification Company Limited,位于荷兰的SUNGO Europe B.V.,位于澳洲的SUNGO Australia,位于德国的SUNGO Cert GmbH和上海沙格企业管理咨询有限公司(含上海总部、武汉分公司和..
- 我要给“海口医用口罩CE认证提供什么资料 速度快”留言
- 更多产品
相关分类