- 2024-09-22 05:10 13
- 产品价格:面议
- 发货地址:江苏省南京栖霞区包装说明:标准
- 产品数量:不限产品规格:不限
- 信息编号:120861987公司编号:4287225
-
朱经理 经理17721529551 (联系我请说明是在阿德采购网看到的信息)
- 进入店铺 在线咨询
- 信息举报
浙江超声微泡小动物 欢迎来电 南京星叶生物科技供应
- 相关产品:
超声微泡
浙江超声微泡小动物
所属行业:代理
- 产品描述
通过超声微泡诱导空化可以改变**血管和细胞膜的通透性。稳定空化(SC)和惯性空化(IC)都可以对*组织的血管壁和细胞膜造成机械干扰,从而提高EPR在**中的作用。超声作用于含有超声微泡的血管,可改变血管壁的通透性,导致药物外渗至间隙。***通透性的改变取决于多种因素,包括壳成分、气泡大小、***直径与气泡直径之比以及超声参数。除了改变血管壁的通透性外,超声微泡的空化还可以增强细胞膜的通透性。气泡的破裂和相关射流的产生可以瞬间破坏相邻的细胞膜。细胞膜内产生小孔,导致可修复或不可修复的声穿孔。在不同的超声参数下,细胞膜内会产生短暂的孔,外源物质因此可以被运输到细胞质中。超声微泡的崩溃还可以引起**组织中的细胞死亡,这进一步减轻了固体应力,并可以减少较深穿透的障碍。研究表明,空化效应可以通过三种不同的机制改变血管和细胞膜通透性:(1)在SC过程中振荡气泡受到规律的机械干扰时,细胞膜电位发生改变以促进内吞摄取。(2)在从SC到IC的转变过程中,振荡泡的体积发生了变化。血管内皮细胞之间的间隙暂时增加,血管内皮的完整性被破坏,从而增强了活性物质的扩散,活性物质可以进入组织。(3)基于IC产生的声孔作用,血管内皮细胞内产生瞬时孔隙。 组织中的微泡检测可以利用超声介导的微泡破坏。浙江超声微泡小动物
超声微泡有效地产生反向散射超声,增强对比度,以便将目标部位(血管)与周围组织区分开来。它还可以比较大限度地减少噪声和背景信号。超声微泡的声学特性产生成像信号,由美国成像仪器检测。使用超声微泡进行诊断的频率范围约为2-18 MHz。共振频率与超声微泡的尺寸成反比,并受超声微泡表面配方特性的影响。超声微泡对波传播幅度的增加具有非线性响应,从而产生谐波频率分量,从而提高了美国成像的空间分辨率。超声微泡被用作造影剂,因为固体和液体颗粒无法提供超声微泡给出的后向散射信号。另一种实时无创成像技术是光声(PA)成像,它需要激光源照射、光敏剂和超声换能器来收集产生的声信号。PA成像是基于热弹性膨胀和造影剂存在下光子到超声转换的光能吸收。PA与超声波相结合,能够以高空间分辨率显示深部组织。Meng等人进行了一项简单的研究,利用超声波将mb转化为纳米颗粒,目的是在小鼠模型的PA成像过程中获得无背景的强信号。超声微泡的广泛应用使研究人员能够调整靶向效率和响应性,例如超声/光热/pH/光触发药物释放。四川超声微泡小动物气泡在靶区域的聚集和药物的释放主要依赖于各种外源性和内源性刺激,并不是由特异性的主动靶向引起的。
靶向超声造影剂的一个潜在***应用是用于基因***。腺病毒和质粒报告基因的非特异性区域递送已经使用超声定向方法完成。较具体地说,腺病毒或质粒载体已被纳入基于白蛋白的超声造影剂中,并使用超声递送到心肌中以破坏靶区域的微泡。携带编码VEGF的质粒的微泡已被用于在超声应用后诱导大鼠心肌血管生成。然而,传统的微球是带负电荷的,对带负电荷的RNA和DNA分子的细胞转染效率较低。Tiukinhoy等人开发了一种带正电的脂质体,具有超声可检测的回声特性。利用血管内超声系统,他们能够在icam-1靶向超声定向基因转染后,在HUVEC细胞中传递和检测荧光素酶基因表达。DNA和微泡的孵育可导致DNA与外壳融合,从而促进共注射。早期的研究表明,通过静脉注射白蛋白微泡,将质粒DNA结合到外壳上,再加上超声波,基因可以传递到心肌。随后的研究开发了将DNA纳入脂质微泡壳的技术,在静脉注射和超声后进行类似的局部转染。虽然有使用静脉注射成功转染的报道,但一项比较静脉注射和动脉注射含有微泡的质粒的研究得出结论,动脉注射在实现局部组织转染方面的效率是静脉注射的200倍。
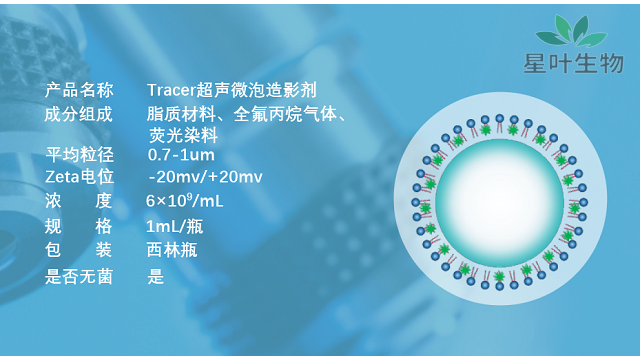
超声微泡造影剂的外壳是有脂质组成的,脂质壳比其他类型的壳(如聚合物)较不稳定,但它们较容易形成并产生较有回声的微泡。脂类是一大类化合物,由一个或多个碳氢化合物或碳氟化合物链共价连接到亲水性头基上,通常由甘油主链组成。脂质壳比其他类型的壳(如聚合物)较不稳定,但它们较容易形成并产生较有回声的微泡。脂质自发地从可溶性聚集体(即胶束和囊泡)吸附到气液界面,并自组装成单层涂层。在纳米尺度上,分子定向使得疏水尾部面向气相,并通过疏水和分散力相互作用,这可以通过增加或减少链长来调节。**主相转变温度的脂质形成高度凝聚的壳层。研究发现,增加链长可以降低壳的表面张力,增加表面粘度,气体渗透阻力和屈曲稳定性,从而产生较强健的微气泡。**近的发现已经改变了关于脂质壳结构的主流范式;现在人们认识到它是一个复杂的多相结构。Kim等人的开创性工作表明,脂质壳由由缺陷(晶界)分隔的平面微畴(晶粒)组成,这影响了力学性能。Borden等人的研究还表明,晶界区域是一个**的、较不稳定的相,富含某些单层成分,如脂聚合物,而微畴主要由卵磷脂组成。这两种相都是稳定微泡所必需的。了解微泡靶向性的方法是在体外受控条件下,以已知的流速、配体和受体密度进行靶向性研究。
微泡的制造通常通过两种通用技术来进行:分散气体颗粒的自组装稳定,以及芯萃取的双乳液制备。**种技术用于脂质或蛋白质基气泡。气体(溶解度低的空气或氟化气体)分散在含有脂质或表面活性剂胶束混合物或经超声变性的蛋白质的水介质中。这些成分沉积在气液界面上,使其稳定下来。有些微泡制剂在水相中保存数月仍能保持稳定。或者,微泡可以快速冷冻和冻干,以便在干燥状态下延长储存时间。水的加入导致微泡水分散体在使用前立即发生重组。聚合微泡是通过双乳液水-油-水技术制备的,该技术通过高剪切混合或超声在水相中产生**溶剂微粒。**“油”溶胶喷口含有溶解的可生物降解聚合物(如聚乳酸-共乙醇酸),以及内部水相的微滴或纳米滴。然后对颗粒进行冻干或喷雾干燥。**溶剂和水被除去,留下一个内部有空隙的聚合物外壳。通常,加入挥发性化合物,如碳酸氢铵、碳氢化合物、氟碳化合物或樟脑,以帮助在颗粒中产生空心**。这类颗粒在干燥状态下储存时非常稳定。它们在水或生物介质中缓慢水解,形成乳酸和乙醇酸,具有完全的生物相容性。颗粒的壳厚和核大小可以通过聚合物、**溶剂、内部水和成孔化合物的浓度和比例来控制。多年来,脂溶药物已被纳入运载工具,以避免全身毒性。重庆超声微泡技术公司
载药超声微泡造影剂的设计之一是使药物由于细胞内pH值的变化或外部光或声音的刺激而释放。浙江超声微泡小动物
超声微泡造影剂在******中应用。***的**早指标之一是单核细胞与内皮细胞的***和附着。这是由白细胞粘附分子(lam)如细胞间粘附分子-1(ICAM-1)的上调介导的。1997年,用于常规心肌超声造影的带有白蛋白壳的超声造影剂在某些病理条件下通过心肌的转运时间较慢。在体外实验中,这些微泡**粘附在表达lam的内皮细胞上。随后,含有针对ICAM-1的单克隆抗体的超声造影剂在体外和体内均显示出良好的结合效率。Villanueva等人和其他人描述了使用微泡对炎症进行主动靶向,其中在炎症反应期间***的内皮细胞使用微泡进行靶向。Takalkar等人使用平行板流室来测定抗icam-1靶向的微泡对白细胞介素-1人工***的内皮细胞的粘附性。增加了40倍与非靶向对照相比,靶向微泡发生了微泡粘附。微泡以高达100s-1的剪切速率粘附,这是较大小静脉的特征。其他白细胞粘附分子在炎症和缺血-再灌注损伤中上调。特别有趣的是p-选择素,它已被超声造影剂靶向炎症小鼠模型。Rychak等人**近证明了可变形微泡与p-选择素的靶向粘附。浙江超声微泡小动物
南京星叶生物科技有限公司是一家专注于脂质体药物递送的企业,主要从事脂质体纳米药物递送技术研发及相关产品的销售。公司目前已经开发了多种药物递送系统,递送的药物包括小分子化合物、蛋白、抗体以及mRNA、siRNA、DNA等各种核酸。同时,公司拥有*的产品超声微泡造影剂(对比剂)、转染试剂和荧光染料等。产品性能稳定,品质优良。南京星叶生物曾于2021年度入选南京紫金山英才栖霞成员计划高层次创新创业人才项目,2021年度入选南京紫金山英才成员计划高层次创新创业人才项目。
欢迎来到南京星叶生物科技有限公司网站,我公司位于文化底蕴厚重、历史遗存丰富的南京市。 具体地址是江苏南京栖霞区公司街道地址,负责人是朱瑞芳。
主要经营超声微泡造影剂|小动物体内转染试剂|脂质体纳米载药技术服务|荧光染料。
单位注册资金:人民币 200 万元 - 300 万元。
我们始终贯彻“客户至上,服务为先”的宗旨,公司一直以客户为中心、为客户创造价值的理念、以品质、服务来赢得市场,衷心希望能与社会各界合作,共创成功,共创辉煌,携手共创美好明天!
本页链接:http://www.cg160.cn/vgy-120861987.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 金华湿度传感器 宣城E+E传感器厂家 EE310-T5C1GA6GB6SBL0SBH180 淮北霍尔电流传感器厂家 EE310-T5C1GA6GB6SBL0SBH180 绍兴扭矩传感器厂家 EE310-T5C1GA6GB6SBL0SBH180 杭州力传感器 池州振动传感器厂家 EE310-T5C1GA6GB6SBL0SBH180 池州位移传感器厂家 EE310-T5C1GA6GB6SBL0SBH180 阜阳温湿度传感器 安徽激光位移传感器厂家 合肥ds18b20温度传感器 六安霍尔传感器厂家 浙江霍尔电流传感器
- 相关文章
- 湖北荧光染料蓝色 值得信赖 南京星叶生物科技供应湖北荧光染料IR780 值得信赖 南京星叶生物科技供应上海荧光染料发射 诚信为本 南京星叶生物科技供应四川高分子荧光染料 推荐咨询 南京星叶生物科技供应陕西荧光染料标记 诚信互利 南京星叶生物科技供应四川高分子荧光染料 值得信赖 南京星叶生物科技供应上海荧光染料发射 诚信经营 南京星叶生物科技供应山西济南荧光染料 创新服务 南京星叶生物科技供应中国台湾荧光染料合成 推荐咨询 南京星叶生物科技供应吉林荧光染料Fluor 680 欢迎咨询 南京星叶生物科技供应山西免疫荧光荧光染料 欢迎来电 南京星叶生物科技供应上海荧光染料发射 欢迎来电 南京星叶生物科技供应
- 我要给“浙江超声微泡小动物 欢迎来电 南京星叶生物科技供应”留言
- 更多产品