- 产品描述
沙格实验室将于合肥实验室建成的轮椅助行器ISO7176系列标准的检测能力,以及上海实验室拥有的性能、微生物检测能力,且出具的报告满足FDA评审要求。
我们的认证、咨询业务更是行业里的翘楚。沙格将为申办510K的您,提供咨询、注册和检测等全程一站式服务。
上市前通知书[510(k)](如果没有被510(k)赦免),或者上市前批准(PMA)。
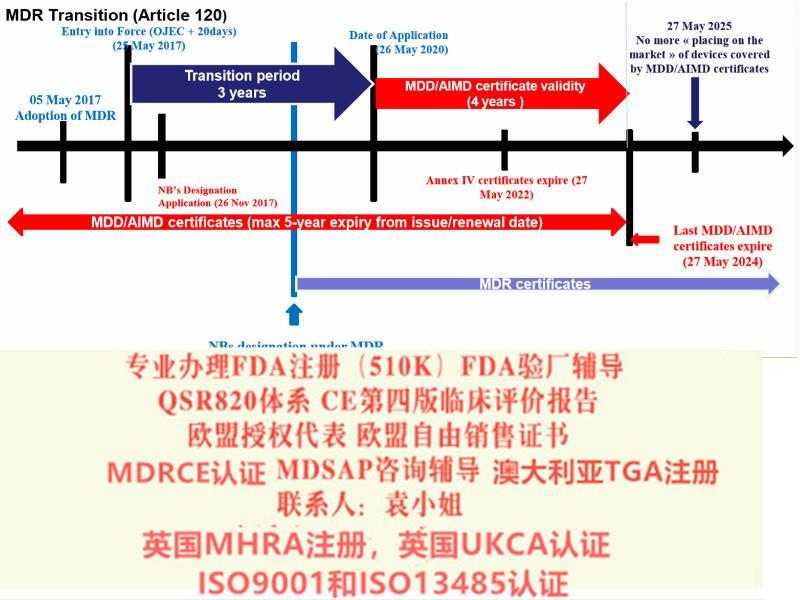
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
基于的行为,必须向FDA递交510(k)的如下所示:
1) 把器械引入美国市场的国内厂家;
如果成品器械厂家根据他们自己的规范装配器械,并在美国上市,那么必须递交510(k)。然而,器械组件厂家并不要求递交510(k),除非这些组件销售给终用户作为替换零件。合同厂家,这些公司根据其他的规范按照合同装配器械,不要求递交510(k)。
2) 把器械引入美国市场的规范制订者;
FDA审查规范制订者与审查厂家几乎一样。规范制订者是制订成品器械规范的人,但是器械按照合同由其他的公司来生产。因此,规范的制订者,而不是合同厂家需要递交510(k)。
3) 改变标注或操作严重影响器械的再包装者或再标注者;
如果再包装者或再标注者严重改变了标注或影响了器械的其他条件,可能会要求递交上市前通知书。此时,你必须确定是否通过修改指南,或增加了警告,禁忌征候等等而显著改变了标注,还有包装操作是否能够改变器械的条件。然而,大多数的再包装者或再标注者并不要求递交510(k)。
4) 把器械引入美国市场的外国厂家/出口商或外国厂家/出口商的美国代理方。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
美国食品和药物管理局( FDA )简介:
FDA 是食品药品监督管理局( Food and Drug Administration )的简称。FDA通常代表也代表美国 FDA ,即美国食品药品监督管理局,美国 FDA 是国际审核机构,由美国国会即联邦授权,从事食品与药品管理的高执法机关;是一个由、律师、微生物学家、药理学家、化学家和统计学家等人士组成的致力于保护、促进和提高国民健康的卫生管制的机构。全球其他许多国家也会通过寻求和接收FDA的帮助来促进并其本国产品的安全。
美国FDA是美国在健康与人类服务部(DHHS)下属的公共(PHS)中设立的执行机构之一。隶属于美国卫生教育福利部,负责全国药品、食品、生物制品、化妆品、兽药、
器械以及诊断用品等的管理。总部设在华盛顿特区及马 利兰州罗克威尔城,机构
庞大,分支机构遍布全国各地。FDA主要分测试和注册两个内容,器械化妆品食品药品类产品需要进行 FDA 注册, FDA 注册可以直接在FDA上进行申请。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
器械FDA认证是器械行业对器械进入美国市场之上市前注册流程的习惯性叫法。严格地讲,应称为FDA注册或FDA器械上市前注册。
FDA对器械的管理是由器械与放射健康中心(CDRH)进行的,该中心负责监督器械的设计、生产、包装、上市等活动。
根据风险等级的不同,FDA将器械分为三类(Ⅰ,Ⅱ,Ⅲ),Ⅲ类风险等级高。FDA将每一种器械都明确规定其产品分类和管理要求,目前FDA器械产品目录有1,800多种。任何一种器械想要进入美国市场,必须首先弄清申请上市产品的分类和管理要求。
FDA针对器械制订了许多法案,并不时地进行修改和补充,但根本的法案并不多,主要包括: 联邦食品、药品与化妆品法案(FD&C Act,根本法案);公众健康服务法案;公正包装和标识法案;健康和安全控制法案;安全器械法案;现代化法案。对这些法案,FDA给予了非常详细的解释,并配套有具体的操作要求。企业在计划进入美国市场前,需仔细评估针对自己产品相关的法规和具体要求(包括不同的美国产品标准要求)。
在明确了以上信息后,企业就可以着手准备有关的申报资料,并按一定程序向FDA申报以获取批准认可。对于所有的器械,企业都需进行企业注册(Registration)和产品列名(Listing)。对Ⅰ类产品(占47%左右),实行的是一般控制 (General Control),绝大部分产品只需进行注册、列名和实施GMP规范,产品即可进入美国市场[其中极少数产品连GMP也豁免,极少数保留产品则需向FDA 递交510(K)申请即PMN(Premarket Notification)];对Ⅱ类产品(占46%左右),实行的是控制(Special Control),除进行注册和列名外,还需实施GMP和递交510(K)申请[极少产品是510(K)豁免];对Ⅲ类产品(占7%左右),实施的是上市前批准,除进行注册和列名外,须实施GMP并向FDA递交PMA(Premarket Application)申请[部分Ⅲ类产品也可以是PMN,即510(k)]。
对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关发给企业;对Ⅱ、Ⅲ 类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国器械市场上直接销售其产品。至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。而通常情况下,GMP检查是在产品上市之后进行。
综合以上内容可知,绝大部分产品在递交510(K)申请、进行企业注册、产品列名后,即可获得FDA批准上市。
SUNGO公司介绍 SUNGO GROUP: SUNGO TECHNICAL SERVICE INC美国公司; SUNGO Certification Company Limited英国公司 SUNGO Europe B.V.荷兰公司; SUNGO Cert GmbH德国公司; SUNGO Australia澳大利亚公司; 上海沙格企业管理咨询有限公司() 上海沙格企业管理咨询有限公司武汉分公司 上海沙格企业管理咨询有限公司广东分公司 SUNGO集团凭借全球网络和专业队伍为全球客户提供法规,在医疗器械行业尤为专长。 我们可以为您提供的自主服务项目主要有: 出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表、欧盟自由销售证书、防护服PPE指令Type5/6认证 出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC品FDA验厂辅导及整改 法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、监局自由销售证。 出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试 上海沙格企业管理咨询公司已经在国内近千家客户提供了相关服务,也受美国几家大型采购集团委托,对其在的供应商进行二方审核工作,我们的客户集中在无纺布行业企业、敷料耗材、病床、轮椅、体外诊断医疗器械行业、大型饲料机械设备企业、电子电器行业类别。公司一直秉承“专业辅导、增值服务、、本土价格”的方针,为客户提供优质的服务。 我们服务过的部分知名企业及上市公司有: 新华医疗、鱼跃医疗、威高集团、阳普医疗、艾迪尔医疗、驼人医疗、恒安集团、康德莱集团、阿蓓纳、上海联影、上海复旦医疗、微创骨科医疗、普罗医学、凯利泰、联医医疗、羚锐制、江西3L、正昌集团、杭州可靠、台钜集团、维达集团、青岛光电、科勒、暴龙眼镜等等
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海浦东陆家嘴公司街道地址,负责人是袁玲。
主要经营ISO13485认证。
本公司以科技为前导,质量为中心,全员为基础,依国际水准,创智博品牌。质量、信誉是公司生存和发展的基石;ISO9000质量体系为保证。选择我们的产品:咨询 管理咨询 ,是正确的决定!
本页链接:http://www.cg160.cn/vgy-108545751.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 绵阳第三方半导体检测 数据准确度高 徐州振动测试第三方检测机构CNAS资质 CNAS/CMA认证 CE注册 绍兴CE认证注册申请代理公司 乐山第三方无损检测方法 报告可追溯 昆明防爆设备维修维护资质申报流程 欢迎电话咨询 了解 烟台第三方检测机构温湿度循环测试 检测机构 海口防爆电器安装检修资质材料攻略 欢迎电话咨询 了解 娄底加拿大认证注册厂 石家庄电子元件扫描电镜测试 高精度 武汉第三方塑料老化检测机构 永州加拿大认证注册价格 成都电子产品管控物质检测公司 3-5工作日出具报告
- 相关文章
- 医用帽2017/745 2017/745 / EU的CE认证升级指南纸尿裤2017/745 MDR医疗器械分类规则瑞代 吸唾管瑞代要求 MDRCE辅导要求腕式血压计的英代认证要求 什么是英国授权代表医用绷带英国代表 什么情况下需要提供英代床边扶手fda认证510k 美国FDA510K认证是什么 如何申请杨克连接管UKREP认证怎么申请 英国授权代表是什么棉签美国FDA510K认证 美国FDA510K认证是什么 如何申请电动救护车担架2017/745 医疗器械MDR法规纱布块MDRCE证书怎么申请 mdrce认证 评估包含什么注射器的UKREP认证怎么申请 英国授权代表是什么口罩MDSAP认证 怎么做
关于上海沙格企业管理咨询有限公司
商铺首页 |
更多产品 |
联系方式
SUNGO公司介绍 SUNGO GROUP: SUNGO TECHNICAL SERVICE INC美国公司; SUNGO Certification Company Limited英国公司 SUNGO Europe B.V.荷兰公司; SUNGO Cert GmbH德国公司; SUNGO Australia澳大利亚公司; 上海沙格企业管理咨询有限公司() 上海沙格企业管理咨询有限公司武汉分公司 上海沙格企业管理咨询有限公司广东分..
- 我要给“荷兰的MDRCE认证周期 口罩FDA510K证书 需要什么资料”留言
- 更多产品