- 产品描述
关于欧盟CE 认证的MDR 2017/745法规升级:
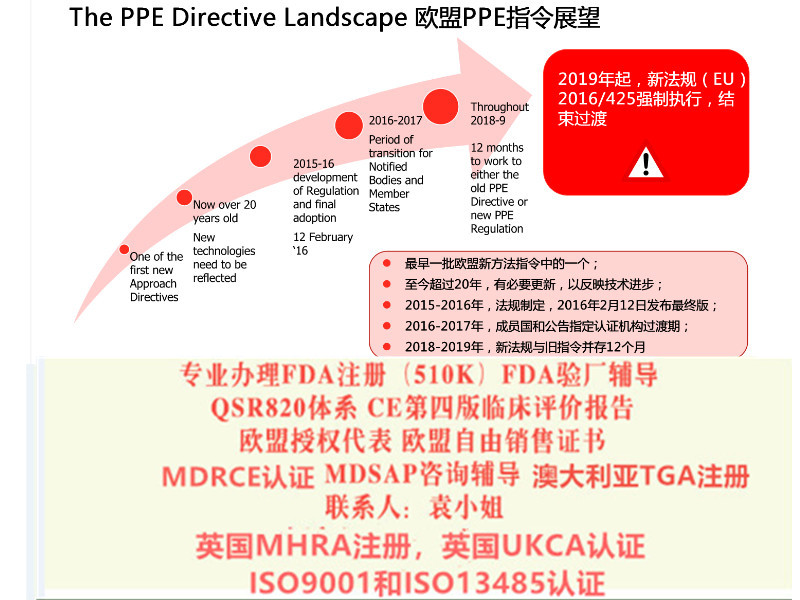
欧盟会规定了MDR 的转换期的要求
2017 年5 月25 日:MDR 和IVDR 生效
2020 年3 月25 日:启动欧盟器械数据库(Eudamed)
2020 年5 月25 日:MDR 实施开始
2022 年5 月25 日:IVDR 实施开始
2024 年5 月25 日:AIMD,MDD 和IVDD 将失效
公司提供的方案包括使用清洁剂清洗,超声波清洗工艺,湿热工艺的验证。
需要办理以下认证可以随时找我 :
1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书
2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册证和生产许可证
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认证:ISO13485咨询和认证
我们的咨询业务
1:MDR法规培训
新法规立法过程、变化及转换期
MDR覆盖的范围,包括和MDD, AIMD的修订要点及主要区别
MDR法规结构及条款清单
MDR分类规则要求
MDR对经销相关方 (Economic Operators)要求
MDR符合性审核程序
质量管理体系的全新要求,以及MDR与ISO 13485:2016的关系
通用和性能要求GSPR
MDR对技术文档TCF的要求
评价CER上市后追踪PMCF的要求
上市后监督PMS的要求
MDR中对器械性标识UDI要求;
欧盟符合性声明 (EU declaration of conformity) 要求
器械欧盟数据库(European Database on Medical Devices, EUDAMED)介绍及输入
公告机构的审核准则
充分准备以应对MDR欧盟器械法规相关的审核
Q&A
2:专项,MDR法规变化-UDI和标签
MDR法规变化-GSPR
MDR法规变化-PMS、PMCF系统
MDR法规变化-质量管理体系
MDR法规变化-技术文件
MDR法规变化-评估,调查
MDR法规变化-风险管理
可用性评价
3.欧代和注册服务SUNGO 荷兰和德国公司可以提供欧盟授权代表服务,同时提供向当地部门申报注册的服务。
4.整体MDR升级换版实施服务 包含上述1、2、3的全部内容,还包括针对公告机构审核开具的不符合的整改服务。
我们的服务流程
1 预评估:简要管理,以确保清楚了解MDR的重要性和业务影响
预评估考虑组织的挑战:管理意识,人员配备能力和可用性,预算影响
2.差异分析 评估对产品、内部资源、组织和预算的影响
检查新的分类规则(MDR I, IIa,IIb,III类),确认现有和产品的符合性评估路线
核对器械定义,确认是否属于扩大范围或属于附录16中所涉及的属于器械的范围
检查产品与关NB机构有关的要求
审查现有技术文档(技术文件)的变更
评估及较新质量管理体系(以下*3点)
检查可用证据和风险管理的充分性,识别差异(*56条)
评估产品标签(附件I*Il1章)
确保上市后监督的安排充分适宜够(*七章*1节)
制定上市后性能跟踪(PMCF,附件XIV B部分)
做好迎接新的警戒需求的规定(*七章*二节)
确保可追溯相关方面的义务(*3章)
3,质量体系评估 评估新IVDR法规下QMS符合标准和流程的程度
增加新法规应用于QMS的要求
协助和识别合规负责人(PPRC)并参与培训
4,公告机构NB确认 选择合适的公告机构,确认公告机构资质及范围
建立新法规实施过渡计划
5,技术文件编制 编制符合MDR要求的技术文件(TD)
编制评估报告、生物学评价报告和风险管理等技术文件等
产品设计开发流程,确保输入及输出的完整性
确认标签、上市后监督、上市后性能跟踪方案
技术文件整改(风险管理报告,性能评估报告,GSPR等)
6,QMS建立:较新现有体系中IVDR用于QMS的要求
定制企业合规QMS系统
执行体系实施计划确保覆盖各个方面及各方面责任
7, 可追溯性UDI 建立可追溯性QMS要求
建立UDI系统程序及制度
确认UDI的规划及实施
MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。在过渡期间,MDR将逐步生效,先是与公告机构和制造商根据MDR申请新证书的能力有关的规定。过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。
-他们在那里的设备,无访问该设备的既不样品,传送到制造商从任何请求MHRA提供此类样本或访问,并传达给MHRA制造商是否打算遵从该请求
-与MHRA合作,采取任何预防或纠正措施,以或(如果不可能)减轻设备带来的风险
-立即告知制造商有关人员,患者和用户的投诉以及有关与其被任命的设备有关的可疑问题的报告
-如果制造商的行为违反了本法规规定的义务:
-终止与制造商的法律关系;和
-将该终止通知MHRA和相关的批准机构。
-进口商或分销商有可能担任英国负责人。
在此期间,仍然可以进行以下MDD的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户较新的相关活动;现有MDD客户较新的申请(包括提前较新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如: · MDD产品的投放截止日期仍为2024年5月26日 · MDD产品供应截止日期仍为2025年5月26日。
SUNGO品牌创建于2006年,立志于成为化的法规技术服务商。我司可以办理:1:欧盟MDR CE咨询,MDR欧盟授权代表,欧盟注册2:欧盟IVDR CE咨询,IVDR欧盟授权代表,欧盟注册3:美国FDA注册,FDA510K4:国内的注册证和生产证5:加拿大的MDEL注册6:ISO13485咨询和认证目前SUNGO在中国、欧洲、北美和澳洲均设有服务机构,服务过的客户较是覆盖了(中国、越南、马来西亚、孟加拉、新加坡)、欧洲(英国、瑞士、瑞典、丹麦、挪威)、北美(美国、加拿大)、南美(阿根廷)、大洋洲(澳大利亚)和非洲(博茨瓦纳、南非)等国家和地区。SUNGO致力于为的生产商和经营者提供市场准入的合规咨询以及**注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。十多年里,SUNGO已为30多家上市公司和制造商,合计5000多家企业提供过相关服务。SUNGO始终追求支持、服务和客户满意。所有客户都有一对一的客服对接以保持经常性的联系,提供在线即时服务,针对贸易中存在的技术壁垒方面的问题提供的支持和解。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的伙伴。我们将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、安全进入市场,为器械行业健康发展贡献力量。因为,所以放心!
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海金山石化公司街道地址,负责人是袁小姐。
主要经营上海沙格企业管理有限公司SUNGO是欧盟授权代表,从事FDA验厂、欧盟自由销售证书、医疗器械单一体系审核MDSAP、CE*四版临床评价报告、MDRCE认证、CE MDR认证、CE技术文件、EU 201。
我们公司主要提供商务服务 认证服务 等服务,我们确信,凭借我们的专业服务和良好的协调、沟通能力,定能使客户在经营生产中无后顾之忧,协助客户不断成长,在合作中与客户实现共赢。欢迎您致电咨询!
本页链接:http://www.cg160.cn/vgy-100729474.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 出具检测报告 抗拉试验 内江电缆拉力检测公司 机械设备EAC认证申请条件 电机俄罗斯GOST认证办理流程 经验丰富 知识产权公司 东莞寮步工商注册哪里找 找九牛会计师 梁平工商注册费用 吉扩工商 口碑良好 美国OTC注册申请 程序 南充FDA OTC认证申请哪家好 张掖单位高压车疏通清洗 时效快 酒泉公司管道疏通电话 团队服务 美国OTC注册申请 哪家公司可靠 阿里FDA OTC认证申请 兰州家庭高压车疏通清洗公司 团队服务 美国OTC注册申请 哪家公司可靠 揭阳FDA OTC认证申请 淮北手机讲课软件 欢迎来电详谈
- 相关文章
- 胰岛素注射针清洗验证方案 UKCA证书 需要什么资料隔离衣的清洗验证方案 EC Rep 需要什么资料创可贴MHRA认证 MHRA注册 的关键纸尿裤MHRA认证 医疗器械产品MHRA注册 新规要求介绍颊面管MHRA注册 英国mhra注册 mhra如何申请电动救护车担架MHRA注册 MHRA认证注册 新规要求介绍手术衣的清洗验证方案 MDR CE证书 需要什么资料眼镜自由贸易证书 欧盟自由销售证书CFS 申请材料介绍病床自由销售证书 自由贸易证书 申请条件丁腈手套自由销售证书 CFS证书 有效期多久护具CFS证书 什么是欧盟自由销售证书 申请条件尿液分析仪美国FDA注册 什么是FDA注册流程
关于上海沙格企业管理咨询有限公司
商铺首页 |
更多产品 |
联系方式
SUNGO品牌创建于2006年,立志于成为化的法规技术服务商。我司可以办理:1:欧盟MDR CE咨询,MDR欧盟授权代表,欧盟注册2:欧盟IVDR CE咨询,IVDR欧盟授权代表,欧盟注册3:美国FDA注册,FDA510K4:国内的注册证和生产证5:加拿大的MDEL注册6:ISO13485咨询和认证目前SUNGO在中国、欧洲、北美和澳洲均设有服务机构,服务过..
- 我要给“安阳MDRCE认证厂商”留言
- 更多产品
相关分类